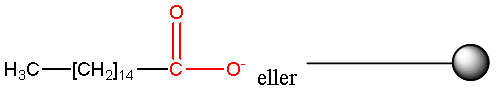Såpe
Såpe er stoffer, nærmere bestemt alkalisalter, som brukes til å løsne smuss fra overflater som hud og klær. Natriumsalter brukes til å lage faste såper, mens kaliumsalter brukes til å lage flytende såper.
Historie[rediger | rediger kilde]
Ved å legge bladene av såpenellik (Saponaria officinalis) i vann får man såpe. Såpe kan lages ved å blande fett, for eksempel planteolje eller dyrefett, med aske og vann. De eldste kjente bevisene for bruk av såpe er 4800 år gamle, fra datidens Babylon. En babylonsk oppskrift på produksjon av såpe, skrevet på en leirtavle, er 4200 år gammel. Under utgravingene etter vulkanutbruddet i Pompei i år 79 fant man en såpefabrikk.
Ordet 'såpe' har sammenheng med protogermansk 'saipo', som ble til latinsk 'sapo'.
Produksjon[rediger | rediger kilde]
Syrekatalysert hydrolyse[rediger | rediger kilde]
Ved syrekatalysert hydrolyse av triglyserider dannes fettsyrer som ved nøytralisering med lut gir såpe. For eksempel:
stearinsyre + lut → såpeløsning → fast såpe (natriumstearat)
C17H35COOH(l) + NaOH(aq) → C17H35COO-(aq) + Na+(aq) → C17H35COONa(s) Hydrokulose er det som skaper reaksjonen mellom atomene.
Basisk hydrolyse[rediger | rediger kilde]
Ved basisk hydrolyse av triglyserider dannes fettsyrers alkalisalter (såpe) og glyserol. For eksempel: 
Virkning[rediger | rediger kilde]
Når en fast såpe løses i vann får vi en løsning med natriumioner og fettsyreioner. For eksempel:
C17H35COONa(s) → C17H35COO-(aq) + Na+(aq)
Vann er et godt løsemiddel, men det er polart og løser derfor ikke upolart smuss. Fettsyreionene, såpeanionene, derimot, har en hydrofob upolar del og en hydrofil polar del:
Såpeanionene kiler seg inn mellom vannmolekylene i overflaten og reduserer derfor overlatespenningen i vannet. Da preller ikke vannet av, men fukter tøyet. Etter hvert som konsentrasjonen av såpe øker, dannes det et enmolekylært lag av såpeanioner på overflaten og i løsningen dannes det miceller. En micelle er en gruppe såpeanioner som er gått sammen i en kuleliknende form der hydrokarbon-halene peker innover mot sentrum av kulen, og de polare hodene ligger ytterst og danner hydrogenbindinger med vann. En micelle inneholder 50-100 såpeanioner så illustrasjonen er ikke helt nøyaktig :

Den upolare delen av såpeanionene søker seg vekk fra det polare vannet og fester seg på smuss. De trenger seg også inn mellom fibrene og mellom fiber og smuss slik at smusset løsner. Den upolare delen av såpeanionene binder seg til fettet slik at de (såpeanionene) ligger som en film rundt hver enkelt fettdråpe. Filmen gjør at dråpene ikke slår seg sammen og ikke fester seg til tøyfibrene igjen. Såpeanionene som festet seg til fibrene har den polare delen ut mot vannet, og vil derfor frastøte filmen rundt det frigjorte fettet.